Protones electrones y neutrones
Fotón
Toda la materia, incluidos los cristales minerales, está formada por átomos, y todos los átomos están formados por tres partículas principales: protones, neutrones y electrones. Como se resume en la Tabla 2.1, los protones tienen carga positiva, los neutrones no tienen carga y los electrones tienen carga negativa. La carga negativa de un electrón equilibra la carga positiva de un protón. Tanto los protones como los neutrones tienen una masa de 1, mientras que los electrones casi no tienen masa.
El elemento hidrógeno tiene los átomos más simples, cada uno con un solo protón y un electrón. El protón forma el núcleo, mientras que el electrón orbita a su alrededor. Todos los demás elementos tienen neutrones además de protones en su núcleo, como el helio, que se representa en la figura 2.2. Los protones con carga positiva tienden a repelerse entre sí, y los neutrones ayudan a mantener unido el núcleo. El número de protones es el número atómico, y el número de protones más neutrones es la masa atómica. En el caso del hidrógeno, la masa atómica es 1 porque hay un protón y ningún neutrón. Para el helio, es 4: dos protones y dos neutrones.
Protones electrones y neutrones 2020
Para entender la electricidad, es útil tener alguna información básica sobre los átomos. Los átomos son los componentes básicos del universo. Todo en el universo está hecho de átomos: cada estrella, cada árbol y cada animal. El cuerpo humano está hecho de átomos. El aire y el agua también están hechos de átomos. Los átomos son tan pequeños que millones de ellos cabrían en la cabeza de un alfiler.
El centro de un átomo se llama núcleo. El núcleo está formado por partículas llamadas protones y neutrones. Los electrones giran alrededor del núcleo en forma de cápsulas. Si el núcleo tuviera el tamaño de una pelota de tenis, el átomo tendría el tamaño de una esfera de unos 1.450 pies de diámetro, o el tamaño de uno de los mayores estadios deportivos del mundo. Los átomos son en su mayoría espacio vacío.
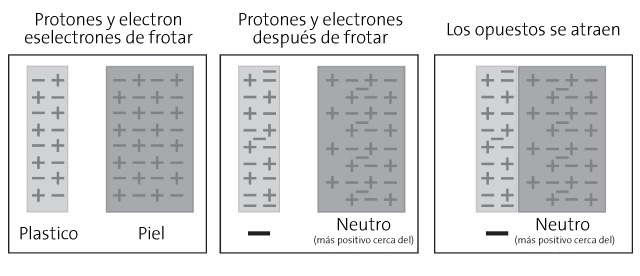
Si el ojo desnudo pudiera ver un átomo, se parecería un poco a un diminuto grupo de bolas rodeadas de gigantescas burbujas invisibles (o caparazones). Los electrones estarían en la superficie de las burbujas, girando constantemente y moviéndose para mantenerse lo más lejos posible unos de otros. Los electrones se mantienen en sus envolturas gracias a una fuerza eléctrica.
Antineutrón
El neutrón es una partícula subatómica, de símbolo n o n0, que tiene carga neutra (no positiva ni negativa) y una masa ligeramente superior a la del protón. Los protones y los neutrones constituyen los núcleos de los átomos. Dado que los protones y los neutrones se comportan de forma similar dentro del núcleo, y que cada uno tiene una masa de aproximadamente una unidad de masa atómica, ambos se denominan nucleones[7] Sus propiedades e interacciones se describen en la física nuclear.
Las propiedades químicas de un átomo están determinadas principalmente por la configuración de los electrones que orbitan alrededor del núcleo pesado del átomo. La configuración de los electrones viene determinada por la carga del núcleo, que a su vez viene determinada por el número de protones, o número atómico. El número de neutrones es el número de neutrones. Los neutrones no afectan a la configuración de los electrones, pero la suma de los números atómico y neutrónico es la masa del núcleo.
Los átomos de un elemento químico que difieren sólo en el número de neutrones se llaman isótopos. Por ejemplo, el carbono, de número atómico 6, tiene un isótopo abundante, el carbono-12, con 6 neutrones, y un isótopo raro, el carbono-13, con 7 neutrones. Algunos elementos se presentan en la naturaleza con un solo isótopo estable, como el flúor. Otros elementos tienen muchos isótopos estables, como el estaño, que tiene diez isótopos estables.
Antineutrino
La teoría atómica de Dalton explicaba muchas cosas sobre la materia, las sustancias químicas y las reacciones químicas. Sin embargo, no era del todo exacta, porque, en contra de lo que creía Dalton, los átomos pueden, de hecho, dividirse en subunidades más pequeñas o partículas subatómicas. Hemos hablado con mucho detalle del electrón, pero hay otras dos partículas que nos interesan: los protones y los neutrones. Ya hemos aprendido que J. J. Thomson descubrió una partícula con carga negativa, llamada electrón. Rutherford propuso que estos electrones orbitan alrededor de un núcleo positivo. En experimentos posteriores, descubrió que hay una partícula más pequeña con carga positiva en el núcleo, llamada protón. También existe una tercera partícula subatómica, conocida como neutrón.
Los electrones son uno de los tres tipos principales de partículas que componen los átomos. A diferencia de los protones y los neutrones, que están formados por partículas más pequeñas y simples, los electrones son partículas fundamentales que no están formadas por partículas más pequeñas. Son un tipo de partícula fundamental llamada leptón. Todos los leptones tienen una carga eléctrica de \(-1\) o \(0\). Los electrones son extremadamente pequeños. La masa de un electrón es sólo 1/2000 de la masa de un protón o un neutrón, por lo que los electrones no contribuyen prácticamente a la masa total de un átomo. Los electrones tienen una carga eléctrica de \(-1\), que es igual pero opuesta a la carga de un protón, que es \(+1\). Todos los átomos tienen el mismo número de electrones que de protones, por lo que las cargas positivas y negativas se «anulan», haciendo que los átomos sean eléctricamente neutros.









Más historias
Decorar con césped artificial: un estilo innovador para mentes creativas
Hacer manualidades contribuye al bienestar
Ideas para amueblar un cuarto juvenil